اکسیژن بخش مهمی از جو است و برای حفظ حیات زمین ضروری است. از آنجایی که بیشتر جرم موجود در آب را تشکیل می دهد، آن نیز بیشتر جرم موجودات زنده را تشکیل می دهد. تمام طبقات اصلی مولکول های ساختاری موجود در موجودات زنده مانند پروتئین ها، کربوهیدرات ها و چربی ها حاوی اکسیژن هستند، همچنین ترکیبات معدنی عمده ای که شامل پوسته های حیوانی، دندان ها و استخوان ها هستند. اکسیژن اکتان (O 2 ) توسط سینوباکتریوم، جلبک و گیاهان از طریق فتوسنتز تولید می شود و در اکثر موجودات زنده روی زمین در تنفس سلولی مورد استفاده قرار می گیرد. اکسیژن برای ایجاد ارگانیزم های بی هوازی (ارگانیسم هایی که نیازمند کمبود اکسیژن برای زنده ماندن هستند) سمی است، که به شکل غالب زندگی زودهنگام روی زمین بود، تا زمانی که O 2 در جو زمین انباشته شود.
خواص شیمیایی اکسیژن
در دما و فشار استاندارد (STP)، دو اتم عنصر برای تشکیل dioxygen، یک گاز دیاتومیک بی رنگ و بی بو، با فرمول O 2 تشکیل می شود . اکسیژن یکی از اعضای گروه کلوكوژن در جدول تناوبی است و یک عنصر غیرمولیت بسیار واكنش پذیر است. به این ترتیب، به راحتی ترکیبات (به ویژه اکسید) را با تقریبا تمام عناصر دیگر تشکیل می دهد. اکسیژن یک عامل اکسید کننده قوی است و دارای درجه دوم انرژی الکترونگاتیوی همه عناصر واکنشی است، دوم فقط فلوئور. با اکسیژن اکسیژن سومین عنصر فراوان در جهان است، پس از هیدروژن و هلیوم، و عنصر فراوان ترین ماده توسط جرم در پوسته زمین، تقریبا نیمی از جرم پوسته را تشکیل می دهد. اکسیژن آزاد بیش از حد شیمیایی واکنش پذیر است به نظر می رسد بر روی زمین بدون اثر فتوسنتزی موجودات زنده، که از انرژی نور خورشید برای تولید اکسیژن عنصری از آب استفاده می کنند. پس از ظهور تکاملی موجودات فتوسنتز، تقریبا 2.5 میلیارد سال پیش، Elemental O 2 تنها در اتمسفر انباشته شد. گاز اکسیژن دیاتومیک در حال حاضر 20.8 درصد از حجم هوا را تشکیل می دهد.
اکسیژن دیاتومیک
دو اتم اکسیژن در اکسیژن دوتوم به صورت شیمیایی به یکدیگر متصل می شوند و با یک پیکربندی الکترون سه گانه اسپین می شوند. این پیوند مرتبه پیوند دو است و اغلب در توصیف ها به عنوان یک پیوند دوگانه یا به عنوان ترکیبی از یک پیوند دو الکترون و دو پیوند سه الکترون ساده می شود. اکسیژن سه گانه (نه با اتمسفر با O 3 اشتباه گرفته می شود) حالت زمین مولکول O2 است. پیکربندی الکترون از مولکول دارای دو الکترون ناپیوسته است که دو اوربیتال مولکولی منحرف را اشغال می کنند. این اوربیتالها به عنوان ضدبدون (تضعیف اوراق بهادار از سه تا دو) طبقه بندی می شوند، بنابراین پیوند اکسیدهای دوامدار ضعیف تر از پیوند سه گانه نیتروژن دوتوم است که در آن تمام اوربیتال های مولکولی پیوند پر شده است اما برخی از اوربیتال های آنتیبیوتیکی ندارند.
در فرم سه گانه طبیعی مولکول های O 2 پارامغناطیس هستند. این بدان معنی است که آنها به دلیل مغناطیسی چرخشی مغناطیسی در حضور یک میدان مغناطیسی خارجی به عنوان مغناطیسی از الکترون های نا هموار در مولکول رفتار می کنند. اکسیژن مایع به یک آهنربا به اندازه کافی جذب می شود که در تظاهرات آزمایشگاهی یک پل از اکسیژن مایع می تواند در برابر وزن خود بین قطب یک آهنربا قوی تقویت شود. اکسیژن یکپارچه نامی است که به چندین نوع انرژی بالایی از O 2 مولکولی داده می شود که در آن تمام الکترونها چرخش می شوند. این نسبت به مولکول های آلی معمولی واکنش بیشتری نسبت به فرم سه گانه اکسیژن مولکولی دارد.
خصوصیات فیزیکی اکسیژن
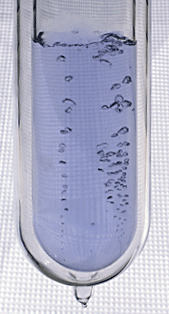
اکسیژن مایع : حباب های اکسیژن از طریق اکسیژن مایع مایع رنگ آبی افزایش می یابند.
اکسیژن محلول در آب بیشتر از نیتروژن است؛ آب حاوی تقریبا یک مولکول O 2 برای هر دو مولکول N 2 است در مقایسه با یک نسبت اتمسفری حدود یک تا چهار. محلول بودن اکسیژن در آب، وابسته به دما است و تقریبا دو برابر (mg / L 14.6) در دمای 0 درجه سانتیگراد، از دمای 20 درجه سانتیگراد (7.6 میلی گرم در لیتر) حل می شود. در دمای 25 درجه سانتی گراد و 1 استاندارد استاندارد (101.3 کیلو پاسکال) هوا، آب شیرین حاوی حدود 6.04 میلی لیتر از اکسیژن در هر لیتر است، در حالی که آب دریا حاوی 4.95 میلی لیتر در لیتر است. در 5 درجه سانتیگراد، محلول شدن به 9.0 میلی لیتر (50 درصد بیشتر از 25 درجه سانتیگراد) در هر لیتر آب و 7.2 میلی لیتر (45 درصد بیشتر) در هر لیتر آب دریا افزایش می یابد.
اکسیژن در 90.20 کروم (-182.95 درجه سانتی گراد، -297.31 درجه فارنهایت)، و در دمای 54.36 K (-218.79 درجه سانتیگراد، -361.82 درجه فارنهایت) انسداد می یابد. هر دو ماده مایع و جامد O 2 مواد شفاف با نور آبی رنگ سبب جذب در قرمز (در مقایسه با رنگ آبی آسمان که به دلیل پراکندگی رایلی در نور آبی است) است.
مایع خلوص بالا O 2 معمولا توسط تقطیر تقطیر هوا مایع به دست می آید. اکسیژن مایع ممکن است از طریق تراکم از هوا، با استفاده از نیتروژن مایع به عنوان یک خنک کننده تولید شود. این یک ماده بسیار واکنشی است و باید از مواد قابل احتراق جدا شود.
