جدول تناوبی عناصر مانند عناصر را با هم طبقه بندی می کند. دیمیتری مندلیف، دانشمند روسی، اولین کسی بود که در سال 1869 یک آرایش گسترده از عناصر ایجاد کرد. مندلیف معتقد بود زمانی که عناصر به ترتیب افزایش جرم اتمی مرتب می شوند، مجموعه های خاصی از خواص به صورت دوره ای تجدید می شوند. اگرچه بیشتر جداول مدرن مدرج در 18 گروه (ستون) عناصر مرتب شده اند، جدول اصلی دوره مندلیف دارای عناصر تشکیل شده به هشت گروه و دوازده دوره (ردیف) بود.
شکل 11: مجاز به استفاده از ویکیپدیا برای انتشار این تصویر به حوزه عمومی است
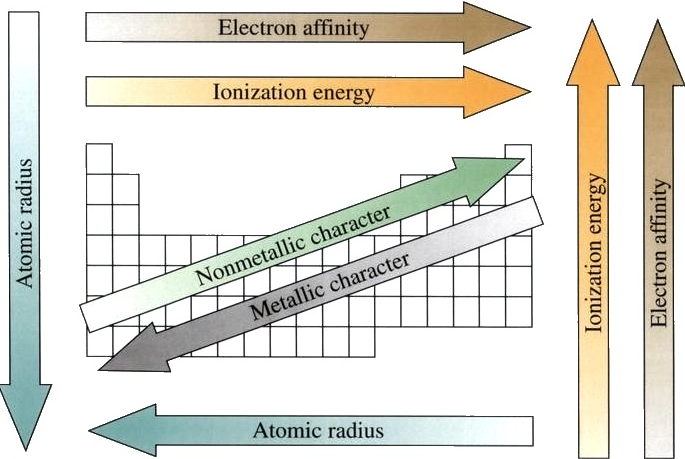
در جدول تناوبی، عناصر دارای خواص مشابه در گروه های مشابه (عمودی) هستند. از چپ به راست، عدد اتمی (z) عناصر از یک دوره به بعد (افقی) افزایش می یابد. گروه ها در بالای هر ستون و دوره های در سمت چپ در کنار هر ردیف شماره گذاری می شوند. عناصر اصلی گروه عبارتند از: گروه های 1،2 و 13 تا 18. این گروه ها دارای بیشترین عناصر فراوان هستند و برای زندگی حیاتی هستند. عناصری که به رنگ صورتی روشن در جدول بالا شبیه به فلزات گذار هستند. دو ردیف عناصر که از z = 58 شروع می شوند، بعضی اوقات به عنوان فلزات درونی انتقال شناخته می شوند و در انتهای جدول استخراج شده و قرار داده شده اند، زیرا اگر جدول به طور مداوم نگه داشته شود، جدول را بیش از حد بزرگ می کند. 14 عنصر بعد از لانتانیم (57 = z =) لانتانید نامیده می شود، و عاملینوی زیر (89 = z) آکینید ها نامیده می شود.
عناصر جدول تناوبی را می توان به دو دسته گسترده، فلزات و غیر فلزات تقسیم کرد. اکثر فلزات هدایت گرما و برق خوب هستند، قابل انعطاف و قابل انعطاف هستند و از لحاظ ذوب به نسبت بالا می باشند. به طور کلی، غیر فلزات غیر خطوط گرمای و الکتریسیته هستند، مواد جامد غیرمجاز هستند و بسیاری از آنها در دمای اتاق، گازها هستند. همانطور که در جدول بالا نشان داده شده است، فلزات و غیر فلزات در جدول تناوبی اغلب توسط خط مورب از راه پله ها جدا می شوند و چندین عنصر در نزدیکی این خط اغلب فلزوئیدی ها (Si، Ge، As، Sb، Te، و At) نامیده می شوند. متالوئید ها عناصری هستند که به نظر می رسند فلزات و به طریقی رفتار می کنند مانند فلزات، اما برخی از خواص غیر فلزی نیز دارند. گروه به دورترین راست جدول، سایه پرتقال، به عنوان گازهای نجیب شناخته می شود. گازهای نجیب به عنوان یک گروه خاص از مواد غیر فلزی درمان می شوند.
روند انعطاف پذیری
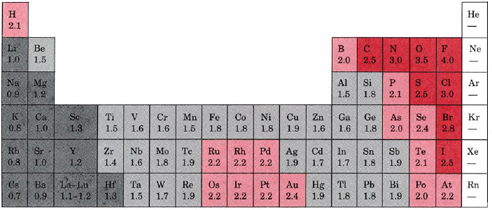
الکترونگاتیوی را می توان به عنوان یک ویژگی شیمیایی توصیف توانایی اتم برای جذب و اتصال با الکترون ها درک کرد. از آنجایی که الکترونگاتیوی یک ویژگی کیفی است، هیچ روش استاندارد برای محاسبه الکترونگاتیوی وجود ندارد. با این حال، رایج ترین مقیاس برای اندازه گیری الکترونگاتیوسی، مقیاس پلینگ ( جدول A2 ) است که به نام شیمیدان لینوس پائینینگ نامگذاری شده است. اعداد اختصاص یافته توسط مقیاس پلینگ به خاطر ماهیت کیفی الکترونگاتیوی بدون بعد هستند. مقادیر الکترونگاتیوی برای هر عنصر در جداول دوره های خاصی یافت می شود. یک مثال در زیر ارائه شده است.
شکل 1: جدول تناوبی از مقادیر الکترونگاتیوی
الکترونگاتیوی گرایش اتم را برای جذب و شکل اوراق قرضه با الکترونها اندازه گیری می کند. این اموال به علت پیکربندی الکترونیکی اتم ها وجود دارد. اکثر اتم ها از قانون اوکته پیروی می کنند (دارای ولنس یا پوسته بیرونی شامل 8 الکترون است). از آنجا که عناصر در سمت چپ جدول تناوبی کمتر از یک پوسته والنس کامل است، انرژی مورد نیاز برای به دست آوردن الکترون ها به طور قابل توجهی بالاتر از انرژی مورد نیاز برای از دست دادن الکترون است. در نتیجه، عناصر در سمت چپ جدول تناوبی، معمولا هنگام تشکیل اوراق قرضه، الکترونها را از دست می دهند. برعکس، عناصر در سمت راست جدول تناوبی انرژی بیشتری برای به دست آوردن الکترون برای ایجاد یک پوسته کامل valence از 8 الکترون. ماهیت الکترونگاتیوی به طور مؤثر توصیف می شود: به این ترتیب که اتم بیشتر به دست آوردن الکترون است، بیشتر احتمال دارد که اتم الکترون را به سمت خود بکشاند.
- از نظر چپ به راست در طول یک دوره از عناصر، الکترونگاتیویته افزایش می یابد. اگر پوسته valence یک اتم کمتر از نصف باشد، انرژی الکتریکی را از دست می دهد تا انرژی بهتری داشته باشد. برعکس، اگر پوسته valence بیش از نیمی از پر شود، آسانتر است که یک الکترون را به داخل پوسته valence بسپاریم تا به اهدای یک.
- از بالا به پایین به پایین گروه، الکترونگاتیویته کاهش می یابد. این به این دلیل است که تعداد اتمی یک گروه را کاهش می دهد و در نتیجه فاصله ای بین الکترون های هسته ای و هسته یا یک شعاع اتمی بیشتر وجود دارد.
- استثناء های مهم از قوانین فوق شامل گازهای نجیب، لانتانیدها و اکتینید ها می باشند . گازهای نجیب دارای پوسته کامل ولنس هستند و معمولا الکترونها را جذب نمی کنند. لانتانیدها و اکتینید ها دارای شیمیایی پیچیده تر هستند که به طور کلی هر روند را دنبال نمی کند. بنابراین، گازهای نجیب، لانتانیدها و اکتینید ها ارزش الکترونگاتیوی ندارند.
- همانطور که برای فلزات گذار، گرچه دارای مقادیر الکترونگاتیویتی هستند، واریانس بین آنها در طول دوره و گروه بالا و پایین وجود دارد. این به این دلیل است که خواص فلزی آنها بر توانایی آنها در جذب الکترون ها به راحتی به عنوان عناصر دیگر تاثیر می گذارد.